細胞外液量は Na+ が腎排泄を通じて調整する
浸透圧は細胞外液の Na+ 濃度で水が行き来して調整される
つまり細胞外液量と浸透圧は別の機構で調整されており、Na+含量の異常は細胞外液量の異常、Na+濃度の異常は水代謝(水バランス)の異常ということになる
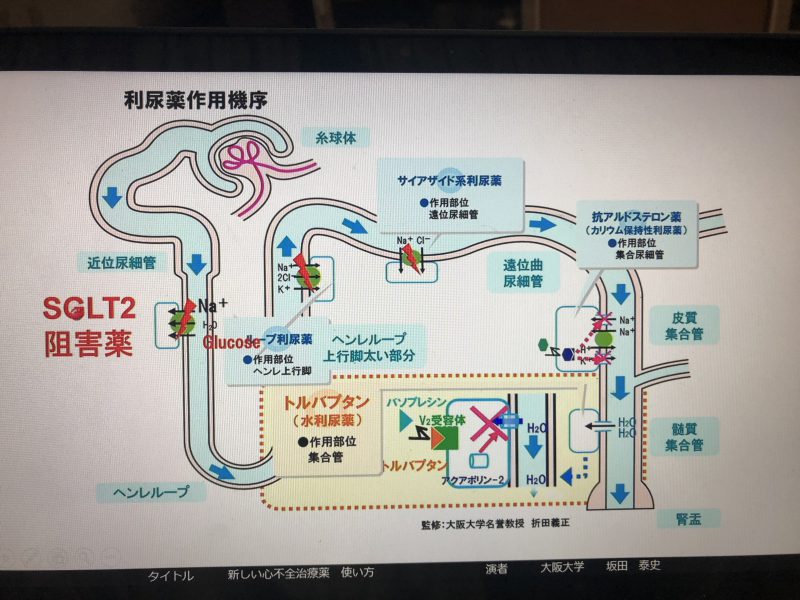
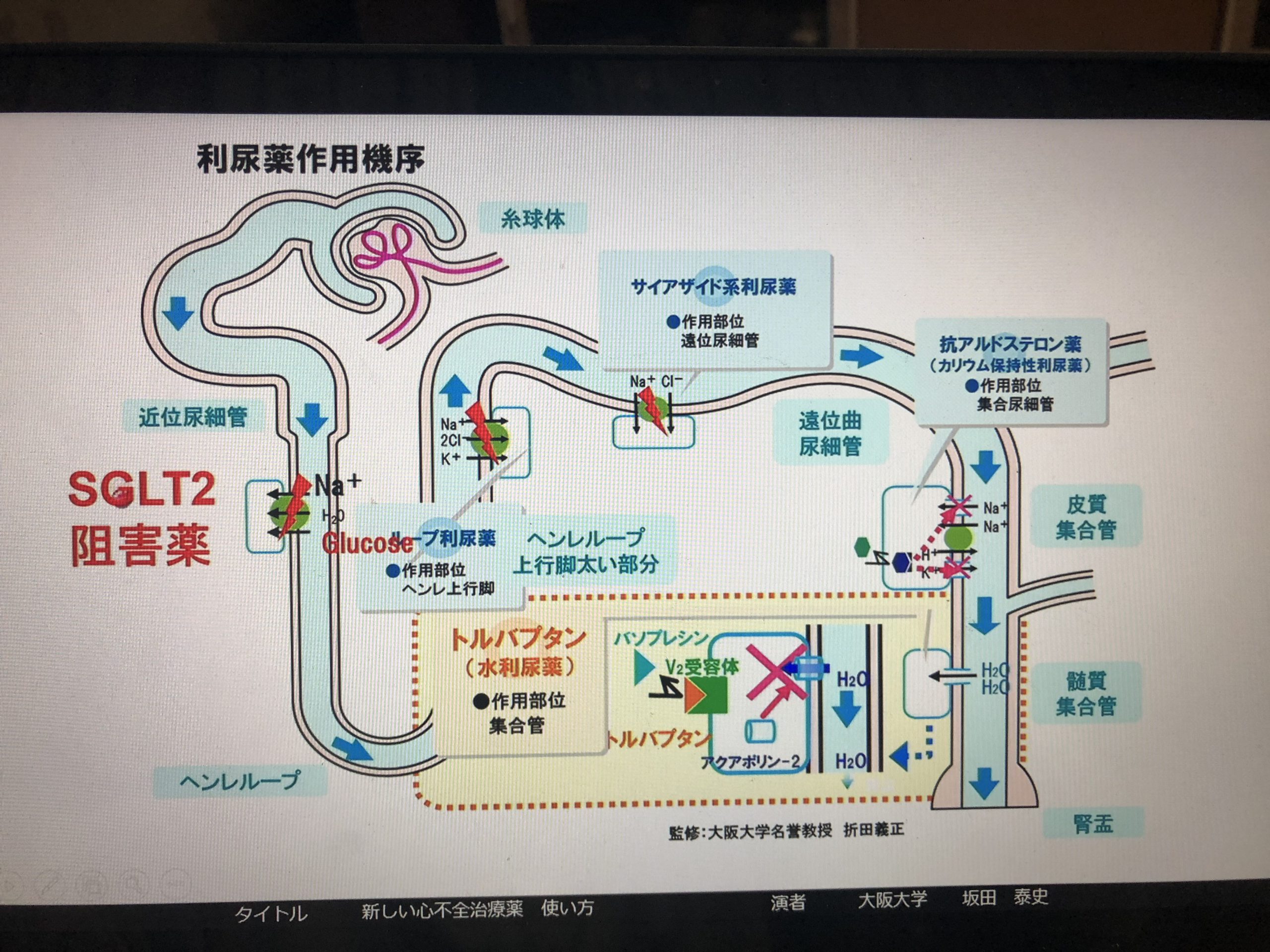
近位尿細管細胞
血管側のATP依存Na-K exchanger によりNa+は細胞内から外にでて細胞内Na+ 濃度が低くなる(陰性化)するとそれを利用して管腔側(尿管側)ではNa+-H+ exchangerやSGLTなどのNa関連トランスポーターでNa+、HCO3-、グルコースなどが再吸収される
Na+の再吸収で管腔内が陰性になるとCl–は細胞間隙から血中に再吸収され、水はアクアポリン1の発現で浸透圧勾配で再吸収され、尿素は受動的に間隙から再吸収される。尿は濾過された状態と同じ等張尿である
中間尿細管 ヘンレループ
対向流増幅系で腎髄質の浸透圧をあげて、水や電解質の再吸収を行う
下行脚ではアクアポリンを介して水が再吸収され、上行脚では トランスポーターNKCC2 (Na+・K+・2Cl–を運ぶ)によってをNa+が再吸入される
上行脚は 皮質にくると TAL(太い上行脚)になる TALはNKCC2 阻害作用のあるループ利尿薬が働く場所で、TAL以遠は遠位尿細管に含まれる NKCC2 がはたらくには K+ を管腔側に返すROMKとCl–を血管側にかえすClC-Kbが必要 TALにあるCaSRカルシウム感受性リセプターはNKCC2を抑制するので高カルシウム血症では低カリウムや多尿をきたす ヘンレループの最後は緻密斑マクラデンサを形成し、尿細管糸球体フィードバックTGFに関与 TGFは高濾過の糸球体をもつ哺乳類が尿を作りすぎて体液を喪失することを防ぐシステムで、尿量が多いと尿中Naが増え原尿中のNa+ 濃度はあがるが、NKCC2 を介してこれを感知し、輸入細動脈が収縮して糸球体毛細血管の圧が下がり、濾過量が減る
遠位尿細管
遠位尿細管の近位側は水は再吸収せず、管腔側でNCCトランスポーターでNa+とCl–を等電位的に再吸収し、希釈尿を排泄する 血管側ではCl-を細胞外に出すClC-Kb、N-K ATPaseが働く サイアザイド系利尿薬はNCC抑制に作用
集合管CD
集合管へのつながりの部分はCNT結合尿細管とよばれ、上皮性NaチャネルENaC、ROMKといった集合管とおなじNa再吸収機構がある 集合管にくらべENaCのNa+再吸収能は10倍 集合管は複数の細胞で構成され、Naや水の再吸収だけでなく、K+、H+、HCO3–の分泌を行い、酸塩基平衡の調整を行っている。アルドステロンが作用する上皮性NaチャネルENaC や、アルドステロンやアミロライドで活性化されるENaCとは異なるNaトランスポーターによるNa+の再吸収も行われる。またANPのリセプターを介してANPによるNa利尿やADHによるアクアポリンを介する水の再吸収、UA-T1尿素トランスポーターでの尿素の再吸収、K+、プロトンの分泌も行われる。ここで再吸収された尿素はヘンレ下行脚で管腔内に分泌され、対向増幅系の髄質の浸透圧勾配を形成する。腎髄質血管ループvasa rectaも対向流交換系を形成し、尿素を髄質に維持する。
腎臓からみた高血圧の治療血圧=V(体内のNa含量)×R(RASの活性)
V型 PRA<0.65ng/mL/時 塩分感受性型 高齢者、肥満者、糖尿病、CKD患者
V drugで体液量をへらし RASが亢進・ PRA の増加、高血圧になればRdrugを追加。
体液量が減らず PRA が増え なければ さらにV drugを追加。
R型 PRA≧0.65ng/mL/時
RdrugでRASを抑制、動脈が拡張すると動脈内の血液量が増加するので、Vdrugを追加してこれを抑制
V drug CCB α1阻害薬 抗アルドステロン系利尿薬 サイアザイド利尿薬
R drug RAS阻害薬(ACE,ARB,レニン阻害薬)、レニン分泌阻害薬(β、中枢性α刺激薬)
糖尿病でアルブミン尿、蛋白尿があれば RAS阻害、なければ高齢化による腎硬化症の関与を考えCCB
サイアザイドの低Naは ①利尿効果の強い、体重減少タイプと②水過剰の体重増加タイプに分かれる。①は利尿薬の効きすぎ 薬剤を中止して輸液 ②は遠位への原尿の低下やAVP過剰による水利尿不全で起こる。これには遺伝的リスクも関与。高齢者、女性、低BMIの人には投与を避け、夏場に処方をさける。遺伝リスクはわからないので 2週間で再診、過剰な利尿や、低Na血症はないかを確認
内分泌疾患で低ナトリウム血症をきたすものは
副腎不全とSIADH
副腎アルドステロンはNa保持ホルモンで、この作用低下で、腎臓からNa喪失、体液量減少をきたす。利尿剤投与時と同じく尿中Na濃度>20mEq/ml ならグルココルチコイド(ヒドロコルチゾン)の補充、朝2/3 夕1/3 投与。日本では食塩摂取が多く、通常ミネラルコルチコイドの補充は不要であるが、低血圧、高カリウム血症等をみとめればフルドロコルチゾン0.05-0.2mgを併用
SIADHは低ナトリウムなのに、AVPの抑制が効かず、抗利尿作用を呈している状態で、RAS抑制、ANP亢進で低ナトリウムでも尿のNa濃度は>20mEq/ml SSRIは SIADHをきたす
視床下部や下垂体の障害による続発性副腎不全ではコルチゾール分泌が低下している コルチゾールは視床下部のAVPを抑制するので、続発性副腎不全ではAVP分泌が亢進し、SIADHと同様の病態を示す
免疫チェックポイント阻害剤は続発性副腎不全をきたす 副腎機能は早朝安静時のコルチゾールを測定 4未満で可能性高く、18以上なら正常。
3%NaClの作り方
120mlの10%NaCl+400mlの0.9%生理食塩水
MR拮抗薬 3剤上市されており、スピロノラクトン、エプレレノン、エサキセレノン(ミネブロ)うちミネブロはステロイド骨格なしで降圧作用が強い
低カリウム性周期性四肢麻痺
甲状腺機能亢進症により、交感神経β刺激に対する組織の反応性が亢進し、Na-K exchanger が活性化し、K+は細胞内に移行。炭水化物をとりすぎると多量に分泌されたインスリンにより、さらにNa-K exchanger が活性化するため、甲状腺ホルモンのコントロールが不十分な場合は炭水化物の摂取に気を付ける
酸塩基平衡
変数は以下のみ
Na
K
Cl
Cre
BUN
PH
PCO2
HCO3
① アシデミア アルカレミア 7.4±0.02
② 代償機構は機能しているか
MAc RAc MAl RAl
HCO3 ↓ 代↑ ↑ 代↓
PaCO2 代↓ ↑ 代↑ ↓
③AG Na-(CL+HCO3)>12で開大 (ちなみにHCO3 24 Na-Cl 36)
④代用機構は予測範囲内か 代謝性の呼吸性代償予測には マジックナンバー15
HCO3+15=予測PaCO2(ここまで減らせるはずなのに) 実測PaCO2と比較(減らしていないなら呼吸性アシドーシスの合併
呼吸性以上ではマジックナンバーは使えす、急性呼吸不全と慢性呼吸不全で異なるグラスを使うこと
⑤補正HCO3 実測HCO3+△AG(AG-12)
<24 AG正常のMAc合併
24-26
>26 MAl合併